Hematologia Clínica
domingo, 8 de abril de 2018
sexta-feira, 6 de abril de 2018
LEUCEMIA MIELÓIDE AGUDA (LMA)
A
leucemia mielóide aguda (LMA) é caracterizada por uma rápida proliferação e
acúmulo de blastos anormais, ou seja, uma transformação clonal das células
precursoras hematopoéticas, mediante processo de múltiplas etapas, por meio da
aquisição de rearranjos cromossômicos ou diferentes mutações genéticas,
acrescida de diminuição da velocidade de autodestruição e parada na
diferenciação celular. A LMA é uma neoplasia maligna relacionada com as células
hematopoéticas, representando um dos tipos mais comuns da leucemia em adultos.
A incidência da LMA aumenta significativamente com o progredir da idade. A
identificação da doença em seu estágio inicial e o encaminhamento ágil e
adequado para o atendimento especializado dão à Atenção Básica um caráter
essencial para melhor resultado terapêutico e prognóstico dos casos.
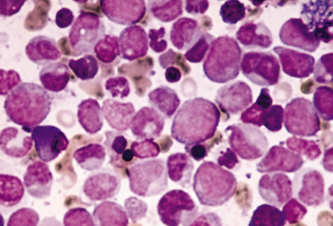
Figura
1 – Células Leucêmicas. Fonte: Google
Imagens
A LMA é classificada com base na
morfologia de acordo com a Classificação FAB (Franco-Americano-Britânica), nos
subtipos FAB-M0 – FAB-M7:
·
M0
Leucemia mieloblástica aguda indiferenciada
·
M1 Leucemia
mieloblástica aguda sem maturação
·
M2 Leucemia
mieloblástica aguda com maturação
·
M3 Leucemia
promielocítica aguda ou promielocítica
·
M4 Leucemia
mielomonocítica aguda
·
M5 Leucemia
monoblástica aguda (5a) ou Leucemia monocítica aguda (5b)
·
M6
Leucemia eritroide aguda ou Eritroleucemia
·
M7
Leucemia megacarioblástica aguda
Classificação OMS da LMA modificada a
partir de 2008
·
LMA
com anormalidades genéticas recorrentes
»
LMA com t(8;21)(q22;q22); AML 1/ETO
»
LMA com inv(16)(p13;q22) ou t(16;16)(p13;q22); CBFbeta/MYH11
»
Leucemia promielocítica aguda com t(15;17)(q22;q12); PML/RARalfa (FAB-tipo: M3
e M3v)
»
LMA com anomalia 11q23; rearranjos MLL/XX
·
LMA
com displasia de multilinhagens
»
LMA sem mielodisplasia (MDS) anterior
»
LMA após MDS
·
LMA
e MDS associada à terapia
»
LMA após terapia com alquilantes
»
LMA após terapia com inibidores da topoisomerase
»
Outros tipos
·
LMA
não classificável nos grupos acima
»
LMA com mínima diferenciação (FAB M0)
»
LMA sem maturação (FAB M1)
»
LMA com maturação (FAB M2)
»
Leucemia mielomonocítica aguda (LMMoA) (FAB M4)
»
LMMoA com eosinofilia anormal (FAB M4Eo)
»
Leucemia monoblástica aguda (FAM M5a)
»
Leucemia monocítica aguda (FAB M5b)
»
Leucemia eritroide aguda (FAB M6)
»
Leucemia megacarioblástica aguda (FAB M7)
»
Leucemia basofílica aguda (FAB M2 Baso)
»
Panmielose aguda com mielofibrose
Sarcoma
mielóide;
Proliferações
mielóides relacionadas com Síndrome de Down;
Neoplasia
de células dentríticas blástica plasmocitoide.
®
CAUSAS
Como
já exposto, a leucemia mielóide aguda (LMA) é uma doença clonal do tecido
hematopoético que se caracteriza pela proliferação anormal de células progenitoras
da linhagem mielóide, ocasionando produção insuficiente de células sanguíneas
maduras normais. Deste modo a infiltração da medula é frequentemente
acompanhada de neutropenia, anemia e plaquetopenia. O mecanismo que leva a
célula progenitora da linhagem mielóide a perder o controle da proliferação
celular, ocasionando a expansão do clone leucêmico, permanece incerto. No
entanto, ativação de proto-oncogenes e mutações em genes
supressores que regulam o ciclo celular parecem estar envolvidos na patogênese
das leucemias.
Alguns genes têm
instruções para controlar o crescimento e a divisão das células. Os genes que
promovem a divisão celular são chamados oncogenes. Os genes que retardam a
divisão celular ou levam as células à morte no momento certo são denominados
genes supressores do tumor. Os cânceres podem ser causados por alterações
no DNA que se transformam em oncogenes ou por desativação dos genes supressores
do tumor.
Cada vez que uma
célula se prepara para se dividir em duas novas células, ela faz uma nova cópia
do DNA em seus cromossomos. Este processo não é perfeito, e podem ocorrer erros
que afetam os genes dentro do DNA. Os cânceres podem ser causados por mutações
no DNA que se transformam em oncogenes ou desligam os genes supressores de
tumor.
Algumas alterações
parecem ter mais de um efeito sobre o prognóstico de um paciente do que outros.
Por exemplo, elas podem afetar a rapidez com que as células leucêmicas crescem.
Como por exemplo:
TRANSLOCAÇÕES - São o tipo
mais comum de alteração no DNA que podem levar à leucemia. Uma translocação
significa que parte de um cromossomo se quebra e se liga a um cromossomo
diferente. O ponto em que o rompimento ocorre pode afetar genes próximos, por
exemplo, pode se transformar em oncogenes ou desligar genes, como o RUNX1 e o
RARa, que normalmente ajudam as células sanguíneas a amadurecerem.
DELEÇÕES - Ocorrem
quando parte de um cromossomo é perdido. Isto pode resultar na perda de um gene
celular que mantém seu crescimento sob controle (gene supressor de tumor).
INVERSÕES - acontece
quando parte de um cromossomo foi invertido. Isso pode resultar na perda de um
gene (ou genes) e a célula não pode ler suas instruções.
ADIÇÃO
OU DUPLICAÇÃO -
significa que existe um ou parte de um cromossomo extra. Isto pode levar a
muitas cópias de alguns genes no interior da célula. O que pode ser um problema
se um ou mais destes genes são oncogenes.
®
FATORES DE RISCO
Alguns pacientes com leucemia
mielóide aguda têm um ou mais fatores de risco conhecidos,
mas outros não. Mesmo quando um paciente tem um ou mais aspectos, não existe
nenhuma maneira de saber se ele realmente causou a leucemia.
As células humanas normais crescem e agem baseadas nas informações contidas nos
cromossomos de cada célula. Alguns fatores de risco aumentam as chances de
causar leucemia mielóide aguda. Entre eles:
·
Idade:
maior prevalência em adultos (80%);
·
Sexo:
maior tendência em desenvolver em pessoas do sexo masculino;
·
Tratamentos
com quimioterapia ou radioterapia aumentam as chances do aparecimento dessa
doença;
·
Exposição
a altos níveis de radiação;
·
Exposição
a componentes químicos perigosos, como o benzeno;
·
Tabagismo;
·
Outras
doenças do sangue como: como mielodisplasia, policitemia vera e trombocitopenia tem maior risco de desenvolver essa leucemia;
®
SINTOMAS
Os
sintomas presentes na leucemia mielóide aguda são:
·
Fadiga,
fraqueza e palidez devido a anemia;
·
Febre
para possíveis infecções;
· Sinais de
sangramento por uma contagem muito baixa de plaquetas, causando contusões,
petequeias ou hematomas sem motivo aparente;
·
Hepatomegalia,
esplenomegalia, linfadenopatia, hipertrofia de gengivas e dor óssea por
infiltração das células leucêmicas nos órgãos;
·
Cefaléia,
convulsões ou alterações visuais na presença de células leucêmicas no sistema
nervoso central.
Figura
2 - Palidez (anemia). Fonte: Google
Imagens
Figura
3 - Hematomas. Fonte: Google Imagens
Figura
4 - Petequias. Fonte: Google Imagens
Figura
5 - Linfadenopatia. Fonte: Google
Imagens
Figura
6 - Hipertrofia de gengiva. Fonte:
Google Imagens
®
DIAGNÓSTICO
De
acordo com a OMS devem ser obtidas amostras de sangue periférico e medula óssea
antes de qualquer intervenção terapêutica e que para estabelecer o diagnóstico
de leucemia mielóide aguda, em que é necessário ter pelo menos 20% de blastos
leucêmicos na amostra de medula óssea (MO) ou sangue periférico.
Os
mieloblastos característicos são células que apresentam pouco citoplasma,
geralmente com finos grânulos azurófilos, tamanho grande medindo de 15 a 20 µm de diâmetro, núcleo arredondado ou
irregular, cromatina reticulada e múltiplos nucléolos. O citoplasma pode conter
bastonetes de Auer, que são grânulos azurófilos anormais nos lisossomos e são
considerados patognomônicos da LMA. Os blastos encontrados são células que não
conseguiram evoluir até o estágio de maturação completa.
Além
da análise morfológica, outras técnicas podem ser usadas para detecção da LMA,
como a técnica de colorações citoquímicas ou as demonstrações das esterases inespecíficas
associadas a precursores monocíticos. Além destes, existe a imunonotipagem
capaz de detectar marcadores que podem caracterizar melhor a origem dos
mieloblastos e finalmente a avaliação genética.
Figura
7 - Blastos no sangue periférico.
Fonte: Google Imagens
Figura
8 - Blastos na medula óssea. Fonte:
Google Imagens
®
EXAMES LABORATORIAIS
O
diagnóstico laboratorial de quase todos os casos de leucemia mielóide aguda é
feito por meio de hemograma e mielograma. A biópsia de medula óssea com agulha
pode ser realizada quando houver dificuldade de diagnóstico.
Outros
exames: Exame do liquor, urina e fezes, dosagens bioquímicas para avaliar
função hepática e renal, coagulograma, exame de fundo de olho, exames
citoquímicos de sangue e medula óssea, avaliação de presença de outras
infecções, exames sorológicos para hepatites A, B e HIV, Imunofenotipagem ou
citometria de fluxo e por fim citogenética.
®
EXAMES DE IMAGEM
Visam
localizar e detectar infiltrações localizadas. Tomografia computadorizada, raio
x, ressonância magnética e ultrassonografia.
®
PROGNÓSTICO
O
prognóstico em geral vai ser subdividido em relação as características do
paciente, as quais dizem respeito a suas condições gerais de saúde e ao clone
leucêmico. Alguns fatores incluem:
·
Grande
quantidade de blastos;
·
Variação
da idade, pois, ocorre deficiência no resultado de pacientes idosos;
·
Maior
frequência de alterações cromossômicas;
·
Limitações
das atividades diárias;
·
Presença
de desordens no sangue;
·
Propagação
da leucemia ao sistema nervoso central, ao cérebro e à medula espinhal;
·
Histórico
do tratamento com quimioterapia e/ou radioterapia, pois, em alguns pacientes
devem ser adiantados;
·
O
paciente responde menos ao tratamento, pois, tem um menor tempo de vida.
®
TRATAMENTO
Figura
9 – Tipos de tratamento. Fonte: Google
Imagens
O tratamento da LMA se
divide em duas etapas. A primeira etapa é denominada indução de remissão, pois,
ocorre a remissão hematológica completa, ou seja, que não haja mais células
anormais no sangue e na medula óssea. A segunda etapa é denominada consolidação
da remissão, pois, é destinada a pacientes que alcançaram a remissão.
O tratamento
farmacológico ocorre na primeira fase (indução de remissão), normalmente é
feita com quimioterapia, incluindo o uso de medicamentos como Citarabina e
Idarubicina, porém, é administrada em pacientes com menos de 60 anos de idade.
Pacientes acima 60 anos de idade, dependendo do seu estado de saúde podem se
beneficiar com um tratamento similar ou menos agressivo. Em alguns casos, a
leucemia pode ter se espalhado pelo cérebro ou pela medula óssea, desse modo,
podendo ser incluso a radioterapia. Dependendo do tipo de LMA, a imunoterapia
pode ser combinada com a quimioterapia.
O
transplante de medula óssea, na maioria das vezes é realizado na segunda fase.
Porém, possui dois tipos de transplantes de medula. O primeiro é o transplante
de medula autólogo, na qual, o transplante pode ser feito com as células
saudáveis do próprio paciente, antes de realizar o tratamento com quimioterapia
ou radiação. O segundo é o transplante de medula alogênico, no qual é de algum
doador compatível e é o único tratamento curativo da LMA. É mais indicado para
pacientes com menos de 60 anos.
REFERÊNCIAS
BRASIL.
Ministério da Saúde. Secretaria de Atenção à Saúde. Diretrizes diagnósticas e terapêuticas leucemia mielóide aguda de
crianças e adolescentes. p. 27, 2014.
Dobbin A, Gadelha MI. Mesilato de imatinibe para o tratamento da
leucemia mielóide crônica. Rev Bras Cancerologia. 2002; 48 (3):
429-38.
Judith Karp, M.D.;
Leucemia mieloide aguda; Revista Leukemia
e LymphomaSociety; Revista 2011, pag 6-8.
JUNQUEIRA,
Pedro C.; ROSENBLIT, Jacob; HAMERSCHLAK, Nelson. História da Hemoterapia no Brasil. Rev. Bras. Hematol. Hemoter.
[online]. 2005, vol.27, n.3, pp.201-207.
LORENZI, THEREZINHA
FERREIRA. Manual de Hematologia:
propedêutica e clinica. 4.ed. Guanabara Koogan. Rio de Janeiro, 2013.
MARTINS S.L.R, FALCÃO R.P.
Importância da imunofenotipagem na Leucemia Mielóide Aguda. Rev. Assoc. Med.
Bras. vol.46 n.1 São Paulo Jan./Mar. 2000 – Acesso em
03.04.2018.
SOUZA L.M,
GORINI M.I.P.C. Diagnóstico de enfermagem em adultos com leucemia mielóide
aguda. Rev. Gaúcha Enferm, Porto Alegre (RS)
2006 set; 27(3):417-25. Acesso em 03.04.2018.
ZAGO,M.A; FALCAO, R.P;
PASQUINI, RICARDO. Tratado de
Hematologia. Editora Atheneu, São Paulo, 2013.
quinta-feira, 5 de abril de 2018
Automação do laboratório de Hematologia
 |
| *Fonte: Google Imagens |
- Contagem de hemácias:
Os valores normais de hemácias variam, dependendo do tipo de amostra e da idade e sexo do paciente, da seguinte maneira: Homens adultos: 4,6 a 6,2 milhões de hemácias/ml de sangue venoso.Mulheres adultas: 4,2 a 5,4 milhões de hemácias/ml de sangue venoso.Crianças: 3,8 a 5,5 milhões de hemácias/ml de sangue venoso.Bebês a termo: 4,4 a 5,8 milhões de hemácias/ml de sangue capilar ao nascimento, iminuindo para 3,8 milhões de hemácias/ml na idade de 2 meses, e aumentando lentamente daí em diante.
- Contagem de plaquetas:As plaquetas ou trombócitos, promovem a coagulação, ou seja, a formação de um coágulo hemostático em locais de comprometimento vascular.
A contagem de plaquetas é o mais importante teste de rastreamento da função plaquetária. As contagens precisas são vitais.
As contagens normais de plaquetas variam entre 150 a 450.000/ml.
- Contagem de leucócitos:A contagem de leucócitos mede o número de leucócitos em um volume de sangue. Contagens anormais altas ou baixas podem sugerir a presença de doenças. Os leucócitos são produzidos na medula óssea, protegem o corpo contra infecções e participam de reações imunológicas. Quando há uma infecção, eles atacam e destroem as bactérias, os fungos ou os vírus causadores.
De forma a assegurar um diagnóstico preciso, os resultados de testes diferenciais devem ser interpretados em relação à contagem de glóbulos brancos totais (4.000 a 10.000/ml). Para adultos, os valores absolutos e porcentagens normais incluem o seguinte:
Basófilos: 0 a 200/ml; 0 a 2%
Eosinófilos: 40 a 500/ml; 1 a 5%
Linfócitos: 880 a 4.000/ml; 22 a 40%
Monócitos: 120 a 1.000/ml; 3 a 10%
Neutrófilos: 1.800 a 7.500/ml; 45 a 75%.
Para crianças, os valores absolutos e porcentagens normais podem diferir. As porcentagens são as seguintes:
Basófilos: 0 a 2%
Eosinófilos: 1 a 5%
Linfócitos: 45 a 75%
Monócitos: 3 a 10%
Neutrófilos: 22 a 40%.
- Diferenciação dos leucócitos: O que são
leucócitos?
Também chamados de glóbulos brancos, os leucócitos são as células sanguíneas que estão envolvidas no processo de defesa do corpo. Eles funcionam juntamente com os macrófagos dos tecidos e o sistema linfático. Os leucócitos podem ser classificados em cinco tipos diferentes onde são levadas em consideração a morfologia nuclear, particularidades da coloração e suas funções. São subdividos também em duas categorias diferentes, onde são analisadas a ausência ou presença de grânulos em seu citoplasma, são elas: granulócitos e agranulócitos.
Tipos de leucócitos:
Neutrófilos
Conhecidos como polimorfonucleares por conta do formato do
seu núcleo, que pode ter diferentes formas, onde pode apresentar de um a cinco umsr diferentes formas ormas conta do
formato do seu n lobos. São divididos em bastões e segmentados e são particularmente associados com infecções
bacterianas e outras reações inflamatórias.
Na forma de bastão ou bastonete, a cromatina é mais
condensada e o núcleo adere formatos diferentes como a letra “S”, uma
ferradura, entre outros.
Já em sua formação mais madura, os neutrófilos
são chamados de segmentados, que é onde seus lóbulos estão unidos por delgados
filamentos de cromatina. Seu núcleo possui cromatina grosseira e condensada. |
| *Fonte: Google Imagens |
Eosinófilos
São leucócitos granulócitos maduros, que contém dois lobos e
cerca de vinte granulações, onde são grosseiras e coradas cos laranja-castanho(
acidófilas), que se coram pela eosina. Estão envolvidos nos processos de defesa
relacionados a infecções parasitárias, principalmente, e alguns processos de
reações alérgicas.
 |
| *Fonte: Google Imagens |
Basófilos
São granulócitos com núcleo dificilmente visualizado devido
a quantidade abundante de grânulos em seu citoplasma. Esses leucócitos também participam em respostas
alérgicas, mas sua principal
função consiste em liberar heparina nas áreas de invasão do organismo, para
evitar a formação de coágulos e permitir a fácil migração dos neutrófilos para
a defesa contra a invasão. Também liberam histamina no local da inflamação, que produz
vasodilatação e aumenta o diâmetro dos poros dos capilares, facilitando a
migração dos demais leucócitos.
Monócitos
É um leucócito agranulócitomononucleado, que possui um
núcleo grande, oval ou denteado e centralizado; cromatina delicada e membrana
delgada. Os monócitos circulantes
são considerados imaturos. Ao deixar a corrente sanguínea, eles alcançam os
tecidos, onde sofrem a fase final da sua maturação para originar os macrófagos.
 |
| *Fonte: Google Imagens |
Linfócitos
Os linfócitos são
divididos em dois tipos principais: os
linfócitos T, que auxiliam na proteção contra as infecções virais e
conseguem detectar e destruir algumas células cancerosas, e os linfócitos B,
que se transformam em células produtoras de anticorpos
(plasmócitos). São leucócitos com núcleo grande e citoplasma sem granulações.
 |
| *Fonte: Google Imagens |
- Citometria de fluxo: A citometria de fluxo (FC) é uma técnica bem estabelecida pela utilização de laser óptico, tem como função realizar a separação, a contagem individual de células e detecção de biomarcadores em proteínas. A técnica por meio de um feixe de laser incidente faz a medição da dispersão e da fluorescência do feixe de laser refletido, a partir da amostra celular. Empregada em estudos de células em fluxo e por possuir amplas aplicações é denominada como citometria de fluxo multiparamétrica (FCM).
Visto
que essa técnica da citometria de fluxo vem ganhando cada vez mais importância,
tanto na área clínica, quanto da pesquisa. Qualquer célula ou partícula
suspensa em meio líquido pode ter diversos parâmetros analisados
simultaneamente, como:
·
Imunofenotipagem;
·
Proliferação Celular;
·
Vida e Morte Celular;
·
Viabilidade;
·
Apoptose e ciclo celular;
·
Comunicação Celular;
·
Quantificação de proteínas;
·
Marcação Intracelular e sinalização celular
por citometria de Fluxo;
·
Marcação de Proteínas Intracelulares Clínica;
·
Caracterização de Células Tronco;
·
Monitoramento de HIV;
·
Diagnóstico de Leucemia;
·
Prova Cruzada de Transplantes;
Trazendo melhoria para hematologia, que foi uma das
primeiras disciplinas médicas a se beneficiar das aplicações clínicas da
citometria de fluxo. Algumas destas aplicações são atualmente utilizadas
regularmente para o diagnóstico ou a seguinte terapêutica das diferentes
afecções. Estas aplicações são relevantes também no estudo funcional das células
sadias que coloca em evidência a natureza patológica das células analisadas.
Em oncologia, a detecção da célula patológica é a
aplicação mais desenvolvida. Esta detecção mostra essencialmente sobre a
medição de um conteúdo anormal de DNA no núcleo da célula tumoral.
A grande vantagem é a capacidade de
avaliar em curto espaço de tempo, grande número de células com alta
sensibilidade e especificidade proporcionando em seus resultados informações
suficientes para diagnósticos precisos. Depois de ter sido introduzido definitivamente
no mercado, várias empresas do setor de engenharia médica e biomédica começaram
a realizar melhorias e ajustes para os aparelhos existentes.
 |
| *Fonte: Google Imagens |
- Histograma
É a curva de frequência da distribuição e tamanho dos
eritrócitos, com o volume na abscissa e a frequência na
ordenada. E quando a curva está situada à esquerda, denota-se
microcitose e à direita, macrocitose.
Interpretação
- Valores aumentados em policitemias
- Valores diminuídos processos anêmicos dediversas
etiologias
- Contagem em câmara
de Neubauer oferece grande variabilidade de erro e dispêndio de tempo-
automação
Índices hematimétricos
- VCM- volume corpuscular médio
- VCM= Ht x 10 / GV
- Correlaciona-se inversamente com o número de GV.
• Causas comuns de
erro:
– Rouleaux
– Conservação prolongada in vitro ⇑ VCM
– Excesso EDTA- desidrata a célula-⇓VCM
– Valores normais: 82 a 92 fL
– Macrocíticas
– Microcíticas
– Normocíticas
Alteração no VCM
• Microcitose
– Hemácias abaixo de 80 fL (adulto).
– Está associada à deficiência de
ferro e talassemias.
•Macrocitose
– Hemácias acima de 100 fL (adulto).
– Está associada à deficiência de vitamina B12,
quimioterapia,
doença hepática, hipotireoidismo e mieloma
Índices hematimétricos
• HCM –
hemoglobina corpuscular média
– HCM= Hb x 10/GV (pg)
– Valores normais – 27 a 32 pg
• CHCM -
concentração de hemoglobina
corpuscular média
– CHCM= Hb x 100
Ht
–
Valoresnormais 32 a36%
• RDW (Red
blood cell Distribution Width) –
expressão numérica da anisocitose
– Variação do volume das hemácias – contadores
automatizados
– Valores normais: 11-14,5
Anisocitose -
Variação no tamanho das hemácias.
Ex: Histograma :
Ex: Histograma :
 |
| *Fonte: Google Imagens |
- O que são flags?
Apesar dos grandes avanços observados nos analisadores hematológicos ainda existem problemas associados com amostras de sangue anormais. Pode-se facilmente compreender a dificuldade que um analisador encontra ao avaliar as células anormais incluindo blastos, granulócitos imaturos, linfócitos atípicos, leucócitos com inclusões citoplasmáticas e ate mesmo amostra com hemiparasitas. De modo geral os contadores são projetados para reconhecer células normais, e quando ha um numero significativo de células anormais com alterações na forma e no tamanho nuclear e celular, possíveis problemas de identificação das células serão encontrados , emitindo assim alerta suspeitos ou flags que indicam o mesmo. Tais alertas sugerem a presença de determinados tipos de celulares diferente dos normais. Portanto, é um resultado qualitativo que implica na necessidade de verificação, geralmente pela avaliação microscópica da lamina de sangue periférico
 |
| *Fonte: Google Imagens |
- Referências- https://labtestsonline.org.br/tests/contagem-de-hemacias- http://www.labes.com.br/hemograma_completo.htm-http://cadernodefarmacia.blogspot.com.br/2012/10/contagem-de-hemacias-e-indices.html-Revista Médica Oficial do Hospital Universitário Da Universidade Federal de Juiz de Fora- Vols. 27(1), 27(2) e 27(3)- Janeiro a Dezembro/2001-http://www.scielo.br/pdf/rbhh/v26n3/v26n3a04-http://revista.unilus.edu.br/index.php/ruep/article/viewFile/39/u2008v5n8e39
Assinar:
Postagens (Atom)